Software de gestión EU MDRde calidadde diseñode base de datos
Añadir a mis favoritos
Añadir al comparador
Características
- Función
- de gestión, de calidad, de diseño, de base de datos, de seguridad, de seguimiento, de cadena de suministro, de etiquetado
- Aplicaciones
- de proceso, médico
- Tipo
- centralizado
- Otras características
- a medida
Descripción
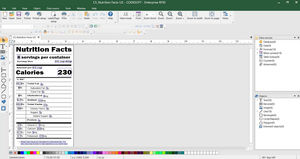
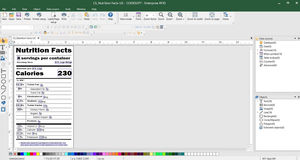
Cree e imprima fácilmente etiquetas que cumplen EU MDR
CODESOFT para la creación de etiquetas EU MDR
Creación de códigos de barras Health Industry Barcode (HIBC) y GS1 Databar
Asistentes fáciles de usar
Cree derechos de usuario y habilite los controles de seguridad de etiquetas
TEKLYNX CENTRAL CFR para la Gestión de etiquetas
Extrae elementos de etiquetas de una base de datos centralizada para etiquetas que cumplen la normativa EU MDR
Proceso de etiquetado automatizado con gestión central para garantizar la aplicación del proceso y control adicional
Las organizaciones que distribuyen dispositivos médicos en la Unión Europea deben cumplir la normativa EU MDR que se estableció en mayo de 2017.
El MDR de la UE está diseñado para garantizar la salud pública y la seguridad del paciente en toda Europa, y para aumentar la calidad y transparencia de los dispositivos médicos en la cadena de suministro de atención médica a través de la estandarización del diseño, aprobación y seguimiento de etiquetas estandarizadas.
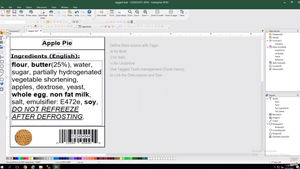
Como resultado, todas las etiquetas de dispositivos médicos, con la excepción de los dispositivos hechos a medida y los dispositivos de estudio/investigación de rendimiento, deberán llevar un Identificador Único de Dispositivo (UDI), que incluye un Identificador de Dispositivo (DI), Identificador de Producto (PI) e Información Legible por Humanos (HRI). Los fabricantes y distribuidores de dispositivos médicos en toda Europa deben cumplir con las normas de etiquetado de la UE MDR.
Catálogos
No hay ningún catálogo disponible para este producto.
Ver todos los catálogos de TEKLYNXBúsquedas asociadas
- Software resolutivo de automatización
- Software resolutivo de gestión
- Software resolutivo de proceso
- Software resolutivo Windows
- Software resolutivo de mando
- Software de CAD
- Software resolutivo en tiempo real
- Software en línea
- Software resolutivo de diseño
- Software de interfaz
- Software de calidad
- Software automatizado
- Software resolutivo de red
- Software para prueba
- Software de creación
- Software resolutivo para informes
- Software 2D
- Software de seguridad
- Software de cálculos
- Software resolutivo de seguimiento
* Los precios no incluyen impuestos, gastos de entrega ni derechos de exportación. Tampoco incluyen gastos de instalación o de puesta en marcha. Los precios se dan a título indicativo y pueden cambiar en función del país, del coste de las materias primas y de los tipos de cambio.